Bài tổng quan do các nhà khoa học Trung Quốc và Mỹ tổng hợp dữ liệu từ nhiều nghiên cứu uy tín về các cơ chế chống khối u và chống sự di căn tế bào ung thư của cordycepin, dược chất điển hình có trong Đông trùng Hạ thảo Cordyceps militaris.
Sự quan tâm của cộng đồng đối với y học bổ sung và thay thế đã tăng lên trên toàn thế giới, do các ứng dụng rộng rãi của nó trong phòng ngừa và điều trị ung thư. Cordycepin là một trong những loại thuốc bổ sung và thay thế phổ biến và quan trọng nhất. Cordycepin (3′-deoxyadenosine), một dẫn xuất của adenosine, lần đầu tiên được phân lập từ Đông trùng Hạ thảo Cordyceps militaris. Cordycepin đã được sử dụng rộng rãi như một hợp chất chống khối u, được phát hiện có tác dụng kháng nguyên, chống di căn và chống tăng sinh, và kích hoạt quá trình tế bào chết theo chu trình (apoptosis). Tuy nhiên, cơ chế hoạt động chống khối u của nó vẫn chưa được biết rõ. Bài tổng quan này sẽ làm rõ các cơ chế chống khối u của Cordycepin, là các cơ chế điều chỉnh những con đường dẫn truyền tín hiệu liên quan đến sự phát triển và di căn của khối u. Cordycepin ức chế sự phát triển của khối u thông qua việc điều chỉnh quá trình apoptosis của khối u, gây ra quá trình bắt giữ chu kỳ tế bào và nhắm mục tiêu vào các tế bào gốc ung thư (Cancer Stem Cells – CSCs). Cordycepin điều chỉnh vi môi trường khối u (tumor microenvironment) thông qua việc ngăn chặn các con đường liên quan đến di căn của khối u. Do đó, Cordycepins có thể là một trong những loại thuốc bổ sung hoặc thay thế thuốc quan trọng trong điều trị ung thư.
Nội dung bài viết
- 1 1. Giới thiệu
- 2 2. Các thành phần hoạt động chính của Cordyceps militaris
- 3 4. Sự điều hòa của cordycepin đối với vi môi trường khối u
- 4 5. Kết luận và triển vọng tương lai
- 5 6. Tài liệu tham khảo
- 6 Tác giả bài viết
- 7 Nghiên cứu về Đông trùng Hạ thảo
1. Giới thiệu
Theo báo cáo mới nhất về xu hướng ung thư toàn cầu do Tổ chức Y tế Thế giới (WHO) công bố, số người mắc ung thư trên thế giới sẽ tiếp tục tăng đều đặn. Người ta ước tính rằng số bệnh nhân ung thư mới gia tăng sẽ lên tới 19 triệu người hoặc thậm chí nhiều hơn vào năm 2025. Ung thư là căn bệnh gây tử vong thứ hai trên thế giới (Anderson và Flanigan, 2015). Ung thư là do sự mất cân bằng giữa sự tiến triển của chu kỳ tế bào và quá trình chết theo chương trình của tế bào (Lowe và cộng sự, 2004). Do đó, phần lớn các loại thuốc y tế chống ung thư phát huy hoạt tính chống tăng sinh của chúng thông qua quá trình bắt giữ chu kỳ tế bào và cảm ứng quá trình apoptosis (Bai và cộng sự, 2017, Evan và Vousden, 2001). Các chất tương tự nucleoside gây độc tế bào là những tác nhân hóa trị liệu đầu tiên được sử dụng để điều trị ung thư. Một số chất tương tự nucleoside gây độc tế bào được nghiên cứu được phân lập từ Cordyceps militaris (Tian và cộng sự, 2015).
Cordycepin lần đầu tiên được tìm thấy từ nấm dược liệu Cordyceps militaris , là loại nấm phát triển ký sinh trên ấu trùng lepidopteron và nhộng côn trùng (Cunningham và cộng sự, 1950). Chi Cordyceps nổi tiếng trong y học cổ truyền Trung Quốc và có nhiều tác dụng đối với sức khỏe lâm sàng bao gồm các hoạt động điều hòa miễn dịch, chống ung thư, chống oxy hóa, chống viêm và chống vi khuẩn (Tuli và cộng sự, 2014 , Yue và cộng sự, 2013). Gần đây, ngày càng nhiều nghiên cứu đã chứng minh Cordycepin, như một hợp chất hoạt tính sinh học của Cordyceps militaris, có vai trò chống khối u (Hsu và cộng sự, 2017, Hwang và cộng sự, 2017a, Wang và cộng sự, 2017a , Wang và cộng sự, 2017b , Zeng và cộng sự, 2017). Tuy nhiên, ít người biết về các hoạt chất cũng như cơ chế hoạt động của các vai trò này. Bài tổng quan tóm tắt cơ chế chống khối u của Cordycepin.
2. Các thành phần hoạt động chính của Cordyceps militaris
2.1. Đặc điểm hóa học của cordycepin
Cấu trúc của Cordycepin rất giống với adenosine và hoạt động giống như chất tương tự nucleoside (Li và cộng sự, 2015 ). Cấu trúc của cordycepin bao gồm một phân tử nucleoside purine (adenine) gắn với một gốc đường ribose. Quá trình tổng hợp hóa học của cordycepin được hoàn thành chủ yếu thông qua việc thay thế nhóm OH ở vị trí 3 trong gốc ribofuranosyl bằng H, tạo ra chất tương tự deoxy của adenosine (Hình 1) (Tuli và cộng sự, 2013 ).
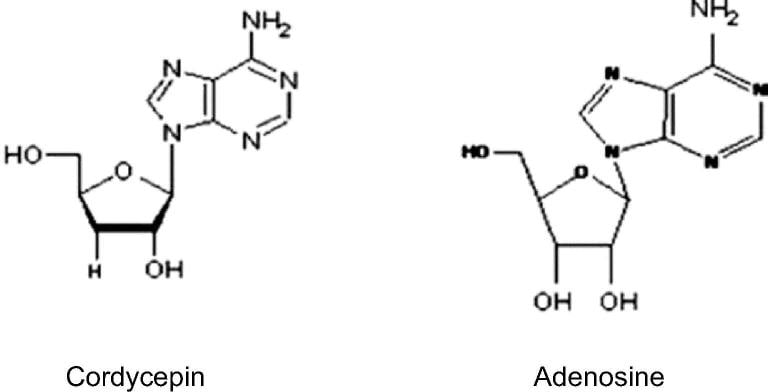
Hình 1: Sự khác biệt về cấu trúc hóa học giữa Cordycepin và adenosine.
2.2. Chức năng của cordycepin
Cordycepin có nhiều tác dụng sinh học và dược lý trong hệ thống miễn dịch, gan, thận, tim mạch cũng như một tác nhân chống ung thư. Những chức năng đó có liên quan đến cấu trúc của nó (Tuli và cộng sự, 2014). Trong quá trình tổng hợp RNA (phiên mã), một số enzym không thể phân biệt giữa adenosine và Cordycepin, dẫn đến việc kết hợp Cordycepin để gây ra sự kết thúc sớm quá trình phiên mã (Chen và cộng sự, 2008, Holbein và cộng sự, 2009). Ngoài ra, IC50 (nồng độ mà tại đó đạt được 50% sự ức chế sự phát triển của tế bào) của cordycepin trong các dòng tế bào ung thư túi mật của người NOZ và tế bào GBC-SD ở 48 giờ tương ứng là khoảng 19,2 μg/mL và 398,1 μg/mL (Wang và cộng sự, 2014). Đối với các dòng tế bào ung thư phổi ở người. IC50 của cordycepin là 60 μg / ml (Hwang và cộng sự, 2017b). Chức năng của điều trị Cordycepin trong khối u phụ thuộc vào loại và nồng độ khối u (Cho và Kang, 2018 , Fong và cộng sự, 2018).
Liều lượng cao của Cordycepin có thể ngăn chặn con đường tín hiệu mTOR (mục tiêu của rapamycin ở động vật có vú) (Wong và cộng sự, 2010). Tên mTOR có nguồn gốc từ thuốc rapamycin, vì thuốc ức chế hoạt động của mTOR. Một số chất ức chế mTOR đã được thử nghiệm như thuốc chống ung thư, vì chúng ngăn chặn ung thư thông qua con đường tín hiệu mTOR (Bjornsti và Houghton, 2004, Sabatini, 2006). Nghiên cứu cho thấy Cordycepin có thể kích hoạt AMPK ngăn chặn hoạt động của phức hợp mTORC1 / mTORC2. Phức hợp bị bất hoạt không thể kích hoạt AKT 1 kinase hoàn toàn, điều này ngăn chặn quá trình truyền tín hiệu mTOR ức chế quá trình dịch mã, đồng thời tăng sinh và phát triển tế bào hơn nữa (Wong và cộng sự, 2010). Những chức năng đó của Cordycepin làm sáng tỏ mối quan hệ cấu trúc – chức năng của chúng, và giải thích thêm về vai trò chống khối u của hợp chất này. Cordycepin đã được chứng minh là điều chỉnh con đường tín hiệu AMPK/mTORC1 để điều chỉnh giảm nhiều loại thuốc kháng HIF-1α trong tế bào ung thư túi mật GBC-SD (Wu và cộng sự, 2014). Các vai trò và cơ chế chống khối u của Cordycepin được mô tả chi tiết bên dưới.
3. Cordycepin ức chế sự phát triển của khối u
Nhiều loại thuốc bổ sung và thay thế được phát triển trong các ứng dụng phòng ngừa và điều trị ung thư do kháng hóa trị và di căn (Wong và cộng sự, 2017). Y học cổ truyền Trung Quốc là một phương pháp điều trị cho liệu pháp bổ sung và thay thế (Wong và cộng sự, 2015, Ye và cộng sự, 2018). Cordycepin là một hợp chất hoạt động và đã được sử dụng trong điều trị ung thư trong các nghiên cứu trước đây.
3.1. Cảm ứng quá trình apoptosis của khối u
Cordycepin có thể gây chết tế bào ung thư theo con đường phụ thuộc vào caspase. Quá trình chết của tế bào ung thư gan ở người (HepG2) được gây ra bởi sự kích hoạt của caspase, tương tác giữa Fas và FADD, và điều chỉnh mức protein của Bid và tBid (Shao và cộng sự, 2016). Cordycepin cũng làm giảm khả năng sống sót của tế bào ung thư biểu mô bàng quang ở người (tế bào T24), được điều chỉnh bằng cách kích hoạt thụ thể adenosine A3 và sự bất hoạt sau đó của các con đường Akt, dẫn đến sự gia tăng Caspase-3 bị phân cắt và quá trình apoptosis (Cao và cộng sự, 2017). Ngoài ra, Cordycepin làm giảm khả năng tồn tại của tế bào, ức chế sự tăng sinh tế bào và tăng cường giải phóng lactate dehydrogenase và tích tụ các loại oxy phản ứng (ROS) của tế bào ung thư vú ở người (tế bào MCF-7 và MDA-MB-231) thông qua việc điều chỉnh sự hoạt hóa của pro protein -apoptotic, chẳng hạn như caspase-3, 8, 9 và ngăn chặn sự biểu hiện của protein chống apoptotic, ung thư hạch bạch huyết tế bào B 2 (Bcl-2) (Wang và cộng sự, 2016).
Cordycepin gây ra quá trình apoptosis của các tế bào ung thư thận ở người bằng cách kích hoạt con đường tín hiệu MKK7-JNK thông qua việc ức chế biểu hiện protein ức chế giống như protein caspase 8 (FLICE) giống như protein phản ứng chết của tế bào (c-FLIP) và do đó kích hoạt Bax / caspase- 3 / Con đường qua trung gian PARP (Hwang và cộng sự, 2017a). Trong ung thư phổi không tế bào nhỏ ở người (NSCLC), quá trình chết rụng do Cordycepin cũng liên quan đến việc điều chỉnh giảm protein c-FLIP, ức chế hoạt động của caspase-8. Cordycepin ức chế sự phát triển của tế bào bằng cách gây ra apoptosis và autophagy. Quá trình tự động kích thích bằng cordycepin được trung gian bằng cách ngăn chặn con đường tín hiệu mTOR trong các tế bào ung thư phổi. Ngoài ra, việc ức chế autophagy cũng có thể nâng cao mức protein của c-FLIP, điều này cho thấy quá trình autophagy do cordycepin kích hoạt đã thúc đẩy sự suy thoái của c-FLIP. Do đó, Cordycepin gây ra quá trình apoptosis thông qua quá trình điều hòa giảm c-FLIP qua trung gian autophagy trong các tế bào NSCLC của người. Ngoài ra, cordycepin cũng ức chế con đường truyền tín hiệu ERK / Slug thông qua việc kích hoạt GSK3β, điều chỉnh Bax để dẫn đến quá trình apoptosis của các tế bào ung thư phổi (Hwang et al., 2017b). Kết hợp lại, cordycepin có thể đóng vai trò là một hợp chất điều trị đầy hứa hẹn, hoạt động trên nhiều mục tiêu phân tử trong điều trị ung thư phổi (Yu và cộng sự, 2017).
Cordycepin cũng gây ra quá trình chết rụng tế bào ung thư theo con đường không phụ thuộc vào caspase. Cordycepin làm giảm quá trình phân bào và tín hiệu EGFR trong một mô hình chuột có khối u ở miệng. Theo đó, phương pháp điều trị đã làm giảm rõ rệt mức độ của các phân tử truyền tín hiệu ki-67 và EGFR để gây ra quá trình tự chết của tế bào ung thư (Hsu và cộng sự, 2017). Đối với ung thư biểu mô tuyến phổi ở người, Cordycepin gây ra quá trình chết rụng tế bào ung thư bằng con đường tín hiệu JNK/Foxo3a được điều chỉnh bằng caveolin-1 và làm giảm đáng kể khối lượng khối u ở chuột khỏa thân (Joo và cộng sự, 2017). Cordycepin cũng làm tăng mức ROS và gây ra apoptosis trong tế bào khối u Leydig của chuột MA-10 nhưng không gây chết tế bào của tế bào Leydig của chuột chính ở nồng độ vừa phải thông qua việc điều chỉnh giảm các con đường tín hiệu p38 MAPK và PI3K/AKT (Pan và cộng sự, 2015) (Bảng 1).
Bảng 1: Vai trò ức chế của Cordycepin đối với sự phát triển của khối u.
| Các loại khối u (dòng tế bào) | Cơ chế chống khối u | Mục tiêu phân tử | Tài liệu tham khảo |
|---|---|---|---|
| Ung thư dạ dày ở người (SGC-7901) | Cảm ứng quá trình apoptosis | PI3K / AKT ↑ | Nasser và cộng sự, 2017 |
| Tế bào ung thư phổi không phải tế bào nhỏ ở người | Cảm ứng apoptosis / autophagy | c-FLIPL ↓ | Yu và cộng sự, 2017 |
| Ung thư gan ở người (HepG2) | Cảm ứng quá trình apoptosis | Caspase-8, Fas, FADD ↑ | Shao và cộng sự, 2016 |
| Tế bào ung thư thận ở người (TK-10) | Cảm ứng quá trình apoptosis | MKK7, JNK ↑ | Hwang và cộng sự, 2017a |
| Tế bào ung thư cổ tử cung ở người (ME180 và tế bào HeLa) | Bắt giữ G2 / M | Cyclin A2 ↓ | Seong da và cộng sự, 2016 |
| Tế bào bệnh bạch cầu ở người (tế bào NB-4 và U937) | Cảm ứng quá trình apoptosis/bắt giữ chu kỳ tế bào | Cyclin A2, cyclin E và CDK2 ↓ p53 ↑ | Liao và cộng sự, 2015 |
| Ung thư bàng quang ở người (T-24) | Cảm ứng quá trình apoptosis | Các thụ thể adenosine A3 ↑ | Cao và cộng sự, 2017 |
| Tế bào ung thư bàng quang ở người (5637 và T-24 tế bào) | Bắt giữ chu kỳ tế bào G2/M | Sự phosphoryl hóa c-Jun | Lee và cộng sự, 2009 |
| Tế bào ung thư vú ở người (MCF-7 và MDA-MB-231) | Cảm ứng quá trình apoptosis | Caspase-3,8,9 ↑, BCL-2 ↓ | Wang và cộng sự, 2016 |
| Ung thư miệng Murine (4NAOC-1) | Cảm ứng quá trình apoptosis, giảm phân bào và tín hiệu EGFR | Caspase-3 ↑ EGFR, IL-17RA ↓ | Hsu và cộng sự, 2017 |
| Tế bào khối u Murine Leydig (MA-10) | Cảm ứng quá trình apoptosis | p38 MAPK ↑ | Hsu và cộng sự, 2017 |
3.2. Bắt giữ chu kỳ tế bào
Cordycepin kết hợp quá trình chết qua trung gian ti thể trong tế bào ung thư dạ dày (tế bào SGC ‑ 7901) với việc điều chỉnh các con đường ngoại nhập ty thể bằng cách ức chế thụ thể A 3 adenosine (A 3 AR) và kích hoạt thụ thể chết DR3, thúc đẩy sự hoạt hóa của protein PI3K/ Akt biểu hiện cũng như sự sụp đổ của điện thế màng ty thể (MMP). Quá trình phosphoryl hóa PI3K / Akt và tổn thương DNA bởi cordycepin gây ra sự sản sinh ROS và điều chỉnh sự ngừng chu kỳ tế bào SGC ‑ 7901 ở pha S (Nasser và cộng sự, 2017). Cordycepin cũng làm tăng độ nhạy cảm với vô tuyến trong các tế bào ung thư cổ tử cung ở người, chẳng hạn như tế bào ME180 và HeLa, đồng thời gây ra sự gia tăng số lượng các tế bào khối u đó trong pha G2/M, có liên quan đến việc cảm ứng quá trình apoptosis qua trung gian p53 và điều chế sự biểu hiện của các phân tử điểm kiểm tra chu kỳ tế bào (Seong và cộng sự, 2016). Sự gia tăng biểu hiện của p53 khi điều trị bằng Cordycepin đã thúc đẩy sự giải phóng cytochrome C từ ty thể đến tế bào, để tiếp tục kích hoạt caspase-9 và thúc đẩy quá trình chết theo chương trình của tế bào bệnh bạch cầu (tế bào NB-4 và U937) (Liao và cộng sự, 2015). Ngoài ra, cordycepin ức chế sự biểu hiện của cyclin A2, cyclin E và CDK2, dẫn đến sự tích tụ của các tế bào bệnh bạch cầu đó ở pha S thông qua việc kích hoạt con đường Chk2-Cdc25A (Liao và cộng sự, 2015).
Gần đây, Lee at al đã phát hiện ra rằng Cordycepin gây ra bắt giữ chu kỳ tế bào G2/M qua trung gian p21WAF1 bằng cách điều chỉnh kích hoạt kinase đầu cuối c-Jun N trong các tế bào ung thư bàng quang ở người. Họ đã chặn chức năng JNK bằng cách sử dụng chất ức chế đặc hiệu JNK và RNA can thiệp nhỏ của JNK để giải cứu sự biểu hiện p21WAF1 phụ thuộc vào cordycepin và giảm protein chu kỳ tế bào (Lee và cộng sự, 2009). Những kết quả này cho thấy rằng cordycepin có thể là một phương pháp điều trị hiệu quả cho bệnh ung thư bàng quang.
3.3. Kháng tế bào gốc ung thư
Tế bào gốc ung thư (Cancer Stem Cells – CSCs) là một nguồn tế bào vô hạn để khởi tạo và duy trì các tế bào ung thư. CSC có thể tạo ra tế bào ung thư thông qua quá trình tế bào gốc tự đổi mới và biệt hóa thành nhiều loại tế bào khối u (Batlle và Clevers, 2017, Visvader, 2011). Do đó, sự đề kháng nội tại của CSC đối với liệu pháp thông thường được coi là mục tiêu điều trị tiềm năng của bệnh ung thư (Reya và cộng sự, 2001). Kích hoạt con đường Wnt/β-catenin là cần thiết cho sự tồn tại và phát triển của CSC, chẳng hạn như tế bào gốc bệnh bạch cầu (LSC) (Nusse và Clevers, 2017). Do đó, nhắm mục tiêu β-catenin được coi là một chiến lược điều trị để điều trị bệnh bạch cầu. cordycepin có thể ngăn chặn tác dụng của β-catenin trong tế bào bệnh bạch cầu bằng cách điều chỉnh GSK-3β để ức chế sự phát triển của LSCs (Ko và cộng sự, 2013). CSC thoát khỏi hóa trị và dẫn đến kháng hóa trị do cảm ứng TGF-β. Cordycepin ức chế hiệu quả khả năng tồn tại của tế bào, tỷ lệ phần trăm tế bào gốc ung thư buồng trứng và mức metalloproteinase ma trận (MMPs) trong tế bào ung thư buồng trứng SKOV-3 do TGF-beta gây ra. Do đó, cordycepin hoạt động như một chất bổ sung cho liệu pháp điều trị ung thư buồng trứng chống lại sự kháng thuốc (Wang và cộng sự, 2017c).
4. Sự điều hòa của cordycepin đối với vi môi trường khối u
4.1. Ức chế sự di cư và xâm lấn của tế bào khối u
Cordycepin ức chế sự di chuyển và xâm nhập của tế bào ung thư biểu mô tế bào vảy ở miệng (OSCC) ở người thông qua điều hòa E-cadherin và điều chỉnh sự biểu hiện protein N-cadherin, ngụ ý ức chế Cordycepin trên quá trình chuyển đổi biểu mô-trung mô (EMT) (Yu và cộng sự, 2017) . Ngoài ra, Cordycepin đã được chứng minh là có khả năng ngăn chặn sự di chuyển của các dòng tế bào u nguyên bào thần kinh đệm ở người U87MG và LN229 trong các thử nghiệm xuyên lành và chữa lành vết thương trong ống nghiệm vì Cordycepin làm giảm biểu hiện protein của α1, kinase kết dính khu trú (FAK), p-FAK, paxillin và p-paxillin. Chất ức chế lysosome NH4Cl có thể ngăn chặn khả năng của cordycepin để ức chế sự biểu hiện của protein kết dính khu trú và sự di chuyển của tế bào thần kinh đệm. Các chất ức chế phosphatase protein Calyculin A và axit okadaic cũng ngăn chặn sự giảm qua trung gian cordycepin ở p-Akt, p-FAK và ngăn chặn sự di chuyển của dòng tế bào khối u. Hematoxylin và eosin nhuộm xenografts chuột đã chứng minh rằng kích thước khối u não đã giảm sau khi điều trị Cordycepin trong vivo. Do đó, cordycepin ức chế sự di cư và xâm nhập của các tế bào u nguyên bào thần kinh đệm ở người bằng cách ảnh hưởng đến sự phân hủy lysosome và hoạt hóa protein phosphatase (Hueng và cộng sự, 2017). Những dữ liệu này phù hợp với phát hiện rằng cordycepin ức chế sự di chuyển và xâm lấn của các tế bào LNCaP (tế bào ung thư biểu mô tuyến tiền liệt ở người). Cordycepin điều chỉnh giảm đáng kể hoạt động của các điểm nối chặt chẽ và ức chế sự biểu hiện và hoạt động của MMP-2 và MMP-9, điều chỉnh sự di căn của khối u. Các vai trò chống di căn này được thực hiện nhờ sự bất hoạt của con đường phosphoinositide 3-kinase (PI3K)/Akt trong các tế bào LNCaP (Jeong và cộng sự, 2012).
4.2. Sự tắc nghẽn di căn của khối u
Các hoạt động chống di căn của cordycepin đã được chứng minh trên các mô hình chuột nơi mà cordycepin ức chế sự di căn gan của khối u ác tính ở chuột B16 trên cơ thể sống (Kubo và cộng sự, 2010). Vai trò tiềm năng của cordycepin trong di căn tế bào hắc tố và các cơ chế phân tử cơ bản đã được đề cập thêm. Zhang và cộng sự phát hiện ra rằng cordycepin có thể ngăn chặn sự xâm lấn của khối u ác tính qua MMPs và sự di căn qua cơ chế actomyosin thông qua sự điều hòa phụ thuộc vào hoạt hóa LXR / RXR của miR-33b. Cordycepin cũng ngăn chặn các biểu hiện của HMGA2, Twist1 và ZEB1 thông qua miR-33b. Việc điều chỉnh tăng biểu hiện miR-33b bằng cordycepin đã ức chế sự di căn của khối u ác tính trên cơ thể sống (Zhang và cộng sự, 2015). Trong một nghiên cứu in vivo khác về khối u ác tính trên chuột, Yoshikawa đã chứng minh rằng sự kết tập tiểu cầu do adenosine-5′-diphosphat (ADP) gây ra đã tăng tốc độ di căn phổi trên khối u ác tính ở chuột. Điều trị bằng Cordycepin làm giảm số lượng nốt di căn phổi thông qua việc ngăn chặn sự kết tập tiểu cầu do ADP gây ra (Yoshikawa và cộng sự, 2009). Những dữ liệu đó chỉ ra rằng cordycepin ức chế sự di căn của khối u ác tính thông qua các cơ chế chống di căn khác nhau.
Cordycepin có thể ngăn chặn EMT gây ra dung hợp ty thể trong tế bào ung thư biểu mô buồng trứng thông qua việc ức chế thụ thể liên quan đến estrogen (ERR)-α, là một yếu tố đồng phiên mã cho các biểu hiện gen liên quan đến dung hợp ty thể. Do đó, cordycepin ngăn chặn sự di căn và di cư của các tế bào ung thư biểu mô buồng trứng qua ức chế hoạt động của ty thể (Wang và cộng sự, 2017b). Ngoài ra, Cordycepin cũng ngăn chặn EMT thông qua việc điều chỉnh TGF-β (Wang và cộng sự, 2017c).
Các khối u rắn phát triển nhanh nếu chúng gây ra sự phát triển của các mạch máu mới, một quá trình được gọi là hình thành mạch khối u, là quá trình chính của sự phát triển và di căn của khối u (Carmeliet và Jain, 2000, Carmeliet và Jain, 2011). Sự hình thành mạch được đánh giá bằng xét nghiệm hình thành ống (Yang và cộng sự, 2008). Thuốc chống tạo mạch đã được sử dụng rộng rãi trong các nghiên cứu lâm sàng để ngăn chặn sự phát triển và di căn của các khối u (Ferrara và Adamis, 2016). Cordycepin ức chế sự hình thành ống (tổng chiều dài của cấu trúc hình ống) của dòng tế bào nội mô tĩnh mạch rốn người (HUVEC) và sự di chuyển của các tế bào đó. Cordycepin cũng ngăn chặn hiệu quả sự xâm nhập và di cư của dòng tế bào ung thư biểu mô tế bào gan (HepG2) (Lu và cộng sự, 2014) (Bảng 2).
Bảng 2: Vai trò ức chế của Cordycepin đối với sự di chuyển và di căn của khối u.
| Các loại khối u (dòng tế bào) | Cơ chế chống di căn | Mục tiêu phân tử | Tài liệu tham khảo |
|---|---|---|---|
| Ung thư biểu mô tế bào vảy ở miệng ở người | Ức chế chuyển đổi biểu mô-trung mô (EMT) | E-cadherin, N-cadherin ↓ | Su và cộng sự, 2017 |
| Ung thư biểu mô tế bào gan ở người (HepG2) | Chống di căn và chống tạo mạch | Lu và cộng sự, 2014 | |
| Tế bào u nguyên bào đệm ở người (U87MG và LN229) | Ức chế hoạt động của tế bào khối u | Sự suy thoái lysosome, hoạt hóa protein phosphatase ↑ | Hueng và cộng sự, 2017 |
| Ung thư biểu mô tuyến tiền liệt ở người (LNCaP) | Ức chế sự di cư và xâm lấn của khối u | AKT ↓ | Jeong và cộng sự, 2012 |
| Ung thư biểu mô buồng trứng ở người (OVCAR-3) | EMT | Hoạt động của ty thể ↓, thụ thể liên quan đến estrogen α ↓ | Wang và cộng sự, 2017b |
| Khối u ác tính ở người | Ức chế sự xâm lấn và di căn | miR-33b ↓, HMGA2, Twist1, ZEB1 ↑ | Zhang và cộng sự, 2015 |
4.3. Sự gián đoạn giữa tế bào ung thư và tế bào mô đệm trung mô
Tế bào mô đệm trung mô (Mesenchymal Stromal Cells – MSC), là loại tế bào chính của vi môi trường khối u, thúc đẩy sự phát triển và di căn của khối u, và các tế bào mô đệm hỗ trợ sự phát triển của khối u và kháng lại hóa trị liệu (Ridge và cộng sự, 2017, Wan và cộng sự, 2013). Do đó, nhắm mục tiêu đến môi trường vi mô dựa trên ngách có thể là một cách tiếp cận mới cho liệu pháp điều trị ung thư (Singh và cộng sự, 2018). Cordycepin làm giảm số lượng tế bào CD34+CD38 trong bệnh bạch cầu như U937 và K562, và gây ra biểu hiện Dkk1 để phá vỡ sự liên kết của cả bệnh bạch cầu và MSCs. Cordycepin cũng ngăn chặn sự gắn kết tế bào của bệnh bạch cầu với MSCs và điều chỉnh giảm N-cadherin trong bệnh bạch cầu và VCAM-1 trong MSCs (Liang và cộng sự, 2017). Do đó, kết quả cho thấy tiềm năng của cordycepin như một loại thuốc đa mục tiêu trong liệu pháp chống di căn.
5. Kết luận và triển vọng tương lai
Nhiều nghiên cứu đã chỉ ra rằng Cordycepin là một hợp chất có giá trị, có thể ức chế nhiều khối u ác tính thông qua các con đường khác nhau. Vì quá trình chết tế bào ung thư do Cordycepin gây ra được thực hiện thông qua con đường đa đích, nên ở một mức độ nào đó rất khó để tế bào ung thư phát triển khả năng kháng thuốc. Hơn nữa, một ưu điểm khác của Cordycepin là tác dụng phụ nhỏ được thể hiện khi ức chế sự phát triển và tiến triển của tế bào ung thư. Do đó, Cordycepin có thể được coi là một trong những ứng cử viên thuốc tuyệt vời để điều trị ung thư.
6. Tài liệu tham khảo
- Anderson B.O., Flanigan J. Novel methods for measuring global cancer burden: implications for global cancer control. JAMA Oncol. 2015;1:425–427.
- Bai J., Li Y., Zhang G. Cell cycle regulation and anticancer drug discovery. Cancer Biol. Med. 2017;14:348–362.
- Batlle E., Clevers H. Cancer stem cells revisited. Nat. Med. 2017;23:1124–1134.
- Bjornsti M.A., Houghton P.J. The TOR pathway: a target for cancer therapy. Nat. Rev. Cancer. 2004;4:335–348.
- Cao H.L., Liu Z.J., Chang Z. Cordycepin induces apoptosis in human bladder cancer cells via activation of A3 adenosine receptors. Tumour Biol. 2017;39 1010428317706915.
- Carmeliet P., Jain R.K. Angiogenesis in cancer and other diseases. Nature. 2000;407:249–257.
- Carmeliet P., Jain R.K. Molecular mechanisms and clinical applications of angiogenesis. Nature. 2011;473:298–307.
- Chen L.S., Stellrecht C.M., Gandhi V. RNA-directed agent, cordycepin, induces cell death in multiple myeloma cells. Br. J. Haematol. 2008;140 682 391.
- Cho S.H., Kang I.C. The inhibitory effect of Cordycepin on the proliferation of cisplatin-resistant A549 lung cancer cells. Biochem. Biophys. Res. Commun. 2018;498:431–436.
- Cunningham K.G., Manson W., Spring F.S., Hutchinson S.A. Cordycepin, a metabolic product isolated from cultures of Cordyceps militaris (Linn.) Link. Nature. 1950;166:949.
- Evan G.I., Vousden K.H. Proliferation, cell cycle and apoptosis in cancer. Nature. 2001;411:342–348.
- Ferrara N., Adamis A.P. Ten years of anti-vascular endothelial growth factor therapy. Nat. Rev. Drug Discov. 2016;15:385–403.
- Fong P., Ao C.N., Tou K.I., Huang K.M., Cheong C.C., Meng L.R. Experimental and in silico analysis of cordycepin and its derivatives as endometrial cancer treatment. Oncol. Res. 2018.
- Holbein S., Wengi A., Decourty L., Freimoser F.M., Jacquier A., Dichtl B. Cordycepin interferes with 3′ end formation in yeast independently of its potential to terminate RNA chain elongation. RNA. 2009;15:837–849.
- Hsu P.Y., Lin Y.H., Yeh E.L., Lo H.C., Hsu T.H., Su C.C. Cordycepin and a preparation from Cordyceps militaris inhibit malignant transformation and proliferation by decreasing EGFR and IL-17RA signaling in a murine oral cancer model. Oncotarget. 2017;8:93712–93728.
- Hueng D.Y., Hsieh C.H., Cheng Y.C., Tsai W.C., Chen Y. Cordycepin inhibits migration of human glioblastoma cells by affecting lysosomal degradation and protein phosphatase activation. J. Nutr. Biochem. 2017;41:109–116.
- Hwang I.H., Oh S.Y., Jang H.J., Jo E., Joo J.C., Lee K.B., Yoo H.S., Lee M.Y., Park S.J., Jang I.S. Cordycepin promotes apoptosis in renal carcinoma cells by activating the MKK7-JNK signaling pathway through inhibition of c-FLIPL expression. PLoS One. 2017;12:e0186489.
- Hwang J.H., Park S.J., Ko W.G., Kang S.M., Lee D.B., Bang J., Park B.J., Wee C.B., Kim D.J., Jang I.S. Cordycepin induces human lung cancer cell apoptosis by inhibiting nitric oxide mediated ERK/Slug signaling pathway. Am. J. Cancer Res. 2017;7:417–432.
- Jeong J.W., Jin C.Y., Park C., Han M.H., Kim G.Y., Moon S.K., Kim C.G., Jeong Y.K., Kim W.J., Lee J.D. Inhibition of migration and invasion of LNCaP human prostate carcinoma cells by cordycepin through inactivation of Akt. Int. J. Oncol. 2012;40:1697–1704.
- Joo J.C., Hwang J.H., Jo E., Kim Y.R., Kim D.J., Lee K.B., Park S.J., Jang I.S. Cordycepin induces apoptosis by caveolin-1-mediated JNK regulation of Foxo3a in human lung adenocarcinoma. Oncotarget. 2017;8:12211–12224.
- Ko B.S., Lu Y.J., Yao W.L., Liu T.A., Tzean S.S., Shen T.L., Liou J.Y. Cordycepin regulates GSK-3beta/beta-catenin signaling in human leukemia cells. PLoS One. 2013;8:e76320.
- Kubo E., Yoshikawa N., Kunitomo M., Kagota S., Shinozuka K., Nakamura K. Inhibitory effect of Cordyceps sinensis on experimental hepatic metastasis of melanoma by suppressing tumor cell invasion. Anticancer Res. 2010;30:3429–3433.
- Lee S.J., Kim S.K., Choi W.S., Kim W.J., Moon S.K. Cordycepin causes p21WAF1-mediated G2/M cell-cycle arrest by regulating c-Jun N-terminal kinase activation in human bladder cancer cells. Arch. Biochem. Biophys. 2009;490:103–109.
- Li G., Nakagome I., Hirono S., Itoh T., Fujiwara R. Inhibition of adenosine deaminase (ADA)-mediated metabolism of cordycepin by natural substances. Pharmacol. Res. Perspect. 2015;3:e00121.
- Liang S.M., Lu Y.J., Ko B.S., Jan Y.J., Shyue S.K., Yet S.F., Liou J.Y. Cordycepin disrupts leukemia association with mesenchymal stromal cells and eliminates leukemia stem cell activity. Sci. Rep. 2017;7:43930.
- Liao Y., Ling J., Zhang G., Liu F., Tao S., Han Z., Chen S., Chen Z., Le H. Cordycepin induces cell cycle arrest and apoptosis by inducing DNA damage and up-regulation of p53 in Leukemia cells. Cell Cycle. 2015;14:761–771.
- Lowe S.W., Cepero E., Evan G. Intrinsic tumour suppression. Nature. 2004;432:307–315.
- Lu H., Li X., Zhang J., Shi H., Zhu X., He X. Effects of cordycepin on HepG2 and EA.hy926 cells: potential antiproliferative, antimetastatic and anti-angiogenic effects on hepatocellular carcinoma. Oncol. Lett. 2014;7:1556–1562.
- Nasser M.I., Masood M., Wei W., Li X., Zhou Y., Liu B., Li J., Li X. Cordycepin induces apoptosis in SGC7901 cells through mitochondrial extrinsic phosphorylation of PI3K/Akt by generating ROS. Int. J. Oncol. 2017;50:911–919.
- Nusse R., Clevers H. Wnt/beta-catenin signaling, disease, and emerging therapeutic modalities. Cell. 2017;169:985–999.
- Pan B.S., Wang Y.K., Lai M.S., Mu Y.F., Huang B.M. Cordycepin induced MA-10 mouse Leydig tumor cell apoptosis by regulating p38 MAPKs and PI3K/AKT signaling pathways. Sci. Rep. 2015;5:13372.
- Reya T., Morrison S.J., Clarke M.F., Weissman I.L. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105–111.
- Ridge S.M., Sullivan F.J., Glynn S.A. Mesenchymal stem cells: key players in cancer progression. Mol. Cancer. 2017;16:31.
- Sabatini D.M. mTOR and cancer: insights into a complex relationship. Nat. Rev. Cancer. 2006;6:729–734.
- Seong da B., Hong S., Muthusami S., Kim W.D., Yu J.R., Park W.Y. Cordycepin increases radiosensitivity in cervical cancer cells by overriding or prolonging radiation-induced G2/M arrest. Eur. J. Pharmacol. 2016;771:77–83.
- Shao L.W., Huang L.H., Yan S., Jin J.D., Ren S.Y. Cordycepin induces apoptosis in human liver cancer HepG2 cells through extrinsic and intrinsic signaling pathways. Oncol. Lett. 2016;12:995–1000.
- Singh M., Yelle N., Venugopal C., Singh S.K. EMT: mechanisms and therapeutic implications. Pharmacol. Ther. 2018;182:80–94.
- Su N.W., Wu S.H., Chi C.W., Liu C.J., Tsai T.H., Chen Y.J. Metronomic cordycepin therapy prolongs survival of oral cancer-bearing mice and inhibits epithelial-mesenchymal transition. Molecules. 2017;22
- Tian X., Li Y., Shen Y., Li Q., Wang Q., Feng L. Apoptosis and inhibition of proliferation of cancer cells induced by cordycepin. Oncol. Lett. 2015;10:595–599.
- Tuli H.S., Sandhu S.S., Sharma A.K. Pharmacological and therapeutic potential of Cordyceps with special reference to Cordycepin. 3. Biotech. 2014;4:1–12.
- Tuli H.S., Sharma A.K., Sandhu S.S., Kashyap D. Cordycepin: a bioactive metabolite with therapeutic potential. Life Sci. 2013;93:863–869.
- Visvader J.E. Cells of origin in cancer. Nature. 2011;469:314–322.
- Wan L., Pantel K., Kang Y. Tumor metastasis: moving new biological insights into the clinic. Nat. Med. 2013;19:1450–1464.
- Wang C., Mao Z.P., Wang L., Zhang F.H., Wu G.H., Wang D.Y., Shi J.L. Cordycepin inhibits cell growth and induces apoptosis in human cholangiocarcinoma. Neoplasma. 2017;64:834–839.
- Wang C.W., Hsu W.H., Tai C.J. Antimetastatic effects of cordycepin mediated by the inhibition of mitochondrial activity and estrogen-related receptor alpha in human ovarian carcinoma cells. Oncotarget. 2017;8:3049–3058.
- Wang C.W., Lee B.H., Tai C.J. The inhibition of cordycepin on cancer stemness in TGF-beta induced chemo-resistant ovarian cancer cell. Oncotarget. 2017;8:111912–111921.
- Wang D., Zhang Y., Lu J., Wang Y., Wang J., Meng Q., Lee R.J., Wang D., Teng L. Cordycepin, a natural antineoplastic agent, induces apoptosis of breast cancer cells via caspase-dependent pathways. Nat. Prod. Commun. 2016;11:63–68.
- Wang X.A., Xiang S.S., Li H.F., Wu X.S., Li M.L., Shu Y.J., Zhang F., Cao Y., Ye Y.Y., Bao R.F. Cordycepin induces S phase arrest and apoptosis in human gallbladder cancer cells. Molecules. 2014;19:11350–11365.
- Wong A.S., Che C.M., Leung K.W. Recent advances in ginseng as cancer therapeutics: a functional and mechanistic overview. Nat. Prod. Rep. 2015;32:256–272.
- Wong, J.H., Cho Wing Sze, S., Ng, T.B., Chi Fai Cheung, R., Tam, C., Zhang, K.Y., Dan, X., Chan, Y.S., Chi Shing Cho, W., Cheuk Wing Ng, C., et al., 2017. Apoptosis and anti-cancer drug discovery: the power of medicinal fungi and plants. Curr. Med. Chem.
- Wong Y.Y., Moon A., Duffin R., Barthet-Barateig A., Meijer H.A., Clemens M.J., de Moor C.H. Cordycepin inhibits protein synthesis and cell adhesion through effects on signal transduction. J. Biol. Chem. 2010;285:2610–2621.
- Wu W.D., Hu Z.M., Shang M.J., Zhao D.J., Zhang C.W., Hong D.F., Huang D.S. Cordycepin down-regulates multiple drug resistant (MDR)/HIF-1alpha through regulating AMPK/mTORC1 signaling in GBC-SD gallbladder cancer cells. Int. J. Mol. Sci. 2014;15:12778–12790.
- Yang L., Huang J., Ren X., Gorska A.E., Chytil A., Aakre M., Carbone D.P., Matrisian L.M., Richmond A., Lin P.C. Abrogation of TGF beta signaling in mammary carcinomas recruits Gr-1+CD11b+ myeloid cells that promote metastasis. Cancer Cell. 2008;13:23–35.
- Ye J., Zhang R., Wu F., Zhai L., Wang K., Xiao M., Xie T., Sui X. Non-apoptotic cell death in malignant tumor cells and natural compounds. Cancer Lett. 2018;420:210–227.
- Yoshikawa N., Kunitomo M., Kagota S., Shinozuka K., Nakamura K. Inhibitory effect of cordycepin on hematogenic metastasis of B16–F1 mouse melanoma cells accelerated by adenosine-5′-diphosphate. Anticancer Res. 2009;29:3857–3860.
- Yu X., Ling J., Liu X., Guo S., Lin Y., Liu X., Su L. Cordycepin induces autophagy-mediated c-FLIPL degradation and leads to apoptosis in human non-small cell lung cancer cells. Oncotarget. 2017;8:6691–6699.
- Yue K., Ye M., Zhou Z., Sun W., Lin X. The genus Cordyceps: a chemical and pharmacological review. J. Pharm. Pharmacol. 2013;65:474–493.
- Zeng Y., Lian S., Li D., Lin X., Chen B., Wei H., Yang T. Anti-hepatocarcinoma effect of cordycepin against NDEA-induced hepatocellular carcinomas via the PI3K/Akt/mTOR and Nrf2/HO-1/NF-kappaB pathway in mice. Biomed. Pharmacother. 2017;95:1868–1875.
- Zhang P., Huang C., Fu C., Tian Y., Hu Y., Wang B., Strasner A., Song Y., Song E. Cordycepin (3′-deoxyadenosine) suppressed HMGA2, Twist1 and ZEB1-dependent melanoma invasion and metastasis by targeting miR-33b. Oncotarget. 2015;6:9834–9853.
Tác giả bài viếtYe Jin (a), Xue Meng (a), Zhidong Qiu (a), Yanping Su (b), Peng Yu và Peng Qu (c) Bài viết gốc: Anti-tumor and anti-metastatic roles of cordycepin, one bioactive compound of Cordyceps militaris Dịch thuật bởi nhóm nghiên cứu Nấm Dược liệu Đông trùng Hạ thảo CordyHappy, Viện Khoa học Sự sống, Đại học Nông Lâm Thái Nguyên. |
